
Nuevas Perspectivas en el Tratamiento de la Incontinencia Urinaria: Luksenburg System
Artículo Publicado en The American Journal of Cosmetic Surgery.
Por: Ariel Luksenburg, MD , Juan J. Barcia, MD, Jorge Gaviria, MD, Roberto Sergio, MD, Santiago Fernandez, MD, Marco A. Pelosi II, MD, and Marco A. Pelosi III, MD.
Resumen:
Introducción:
La incontinencia urinaria (IU) es un importante problema clínico que afecta a millones de mujeres en todo el mundo. Describimos el sistema Luksenburg, un procedimiento mínimamente invasivo para el tratamiento de la IU en mujeres, utilizando inyecciones de plasma rico en plaquetas (PRP) y hilos de poliéster caprolactona (PCL).
Material y Métodos:
Se evaluaron un total de 302 pacientes con IU, con una edad media de 52 años, mediante historia clínica detallada, examen físico, diario urinario, pruebas de laboratorio completas, ecografía, estudios urodinámicos y completando el Cuestionario Internacional de Consulta sobre Incontinencia – Forma Corta de Incontinencia Urinaria (ICIQ-UI SF). Bajo anestesia local, se inyectó PRP a través de la pared vaginal anterior, y se colocaron hilos de PCL en los espacios parauretrales, suburetrales y uretrovaginales laterales, utilizando instrumentos desarrollados para un rendimiento seguro y efectivo. Los pacientes fueron analizados a las 1, 2, 4, 8 semanas y 6 meses después del tratamiento. Veinte pacientes fueron biopsiados antes de la operación y 60 días después del tratamiento.
Resultados:
Los síntomas, la puntuación del ICIQ-UI SF y los estudios urodinámicos postoperatorios mejoraron significativamente en el 95% de los pacientes con IU grado I, en el 92% de los pacientes con IU grado II y en el 30% de los casos de IU grado III. Las biopsias posteriores al tratamiento mostraron una malla tridimensional de tejido conectivo denso. No se observaron complicaciones ni efectos adversos. Todos los pacientes declararon estar satisfechos con los resultados, volverían a someterse al procedimiento y lo recomendarían.
Discusión:
El sistema Luksenburg fortalece los espacios parauretrales, suburetrales y uretrovaginales laterales, así como la mucosa de la pared vaginal anterior. La combinación de las inyecciones de PRP y la colocación de hilos de PCL crea una estructura fibrosa y absorbible similar a una malla, con el objetivo de aumentar la resistencia uretral, de modo que la presión intravesical no supere la presión uretral durante el esfuerzo.
Conclusiones:
Estos resultados respaldan que el sistema Luksenburg es una alternativa segura y rentable en pacientes con todos los grados de IU, reduciendo la necesidad de procedimientos quirúrgicos invasivos.
Introducción
La incontinencia urinaria por esfuerzo (IU) es un importante problema clínico que afecta a millones de mujeres en todo el mundo. La pérdida de orina está relacionada con un aumento de la presión intraabdominal y puede tener una causa anatómica, debido a la hipermotilidad uretral en la que los elementos de retención uretral están debilitados o dañados, o debido a una deficiencia funcional intrínseca del esfínter. Los tratamientos actuales pueden ser no quirúrgicos o quirúrgicos. Todos ellos tienen tasas de éxito variables y posibles complicaciones. Además, los tratamientos quirúrgicos tienen un costo relativamente alto. Anteriormente, hemos descrito un tratamiento mínimamente invasivo para pacientes que sufren de IU leve mediante el fortalecimiento del suelo pélvico, utilizando una combinación de inyecciones de plasma rico en plaquetas (PRP) a través de la mucosa de la pared vaginal anterior y la colocación de hilos de polidioxanona (PDO) en los espacios parauretrales, suburetrales y uretrovaginales laterales, con el fin de crear un soporte absorbible similar a una malla. La malla creada por las inyecciones de PRP y los hilos de PDO resulta en un aumento de la resistencia uretral con reducción de la hipermovilidad uretral, de modo que la presión intravesical no supere la presión uretral durante el estrés físico. En este artículo describimos una mejora del método PRP/PDO, al que llamamos el sistema Luksenburg, y presentamos los resultados de nuestra serie de 302 pacientes. Los autores han desarrollado un tratamiento mínimamente invasivo para pacientes que sufren de incontinencia urinaria leve con el objetivo de fortalecer el suelo pélvico, utilizando una combinación de inyecciones de plasma rico en plaquetas (PRP) a través de la mucosa de la pared vaginal anterior, y la colocación de hilos de polidioxanona en los espacios parauretrales, suburetrales y uretrovaginales laterales, para crear un soporte absorbible similar a una malla.
Materiales y método
Tratamos a un total de 302 pacientes con una edad mediana de 52 años (rango 40-72): 192 con IU leve (grado I), 72 con IU moderada (grado II) y 38 con IU grave (grado III). La evaluación del grado se realizó según el índice de gravedad, es decir, basado en información sobre la frecuencia (4 niveles) y la cantidad de pérdidas (2 o 3 niveles). Al multiplicarlos, se alcanza un valor de índice (1-8 o 1-12). Este valor de índice se categoriza además en un índice de gravedad de 3 o 4 niveles. Las preguntas utilizadas para evaluar el grado de IU en mujeres fueron las siguientes: Las preguntas utilizadas para evaluar el grado de incontinencia urinaria en mujeres fueron las siguientes:
¿Con qué frecuencia experimenta pérdida de orina?
- Menos de una vez al mes
- Algunas veces al mes
- Algunas veces a la semana
- Todos los días y/o noche
¿Cuánta orina pierde cada vez?
- Gotas
- Salpicaduras pequeñas
- Más
El índice de severidad se crea multiplicando los resultados de las preguntas 1 y 2. En el índice de severidad de tres niveles, las respuestas a la segunda pregunta se agregan primero en gotas (1) y más (2), y luego se multiplican con la frecuencia, dando como resultado los siguientes valores de índice (1-8):
1-2 → leve
3-4 → moderado
6-8 → severo
El índice de severidad de cuatro niveles se basa en los siguientes valores de índice (1-12):
1-2 → leve
3-6 → moderado
8-9 → severo
12 → muy severo
Todos los pacientes estaban en el período menopáusico y con hasta 3 partos. Tras una historia clínica detallada y un examen físico, se evaluó a los pacientes con un diario urinario de 3 días, análisis de orina completo, cultivo de orina, ICIQ-SF (Cuestionario de Consulta Internacional sobre Incontinencia – Formulario Corto), ultrasonografía (para confirmar la hipermovilidad uretral y excluir patologías incidentales), pruebas bioquímicas de rutina y estudios urodinámicos (uroflujometría libre, cistometrograma, presión del flujo de presión cistomanometría, presión detrusora y residuo de orina).
Se excluyeron del estudio a pacientes que habían sido sometidas a cirugía previa de incontinencia, cirugía uretral o de la pared vaginal anterior, cesárea, inyecciones bulking parauretrales y suburetrales, prolapso uterino o rectal concomitante y pacientes con infecciones del tracto urinario o trastornos hemorrágicos.
Una semana antes del procedimiento, se realizó un cultivo de orina para confirmar la ausencia de infección urinaria. Si era posible, se suspendieron los anticoagulantes orales 24 horas antes. Todos los aspectos de nuestro protocolo se llevaron a cabo en nuestra clínica privada y se realizaron de acuerdo con las pautas aprobadas por el Ministerio de Salud Pública (Uruguay) relacionadas con los estándares éticos del Comité de Investigación que Involucra a Sujetos Humanos y con la Declaración de Helsinki. Cada paciente firmó un consentimiento informado después de una explicación detallada del proceso de tratamiento, los posibles beneficios y riesgos, las complicaciones potenciales, la inclusión de los resultados en un documento y el hecho de que se trataba de un nuevo tratamiento. Todos los pacientes recibieron 2 tratamientos separados por 30 días. Cada paciente fue monitoreado a los 7, 15, 30 y 60 días después del tratamiento. Los estudios urodinámicos se repitieron 6 meses después.
Se definió la mejora de la IU cuando la historia clínica del paciente y los registros diarios mostraron una reducción en los índices de gravedad, estudios urodinámicos cercanos a la normalidad y evidencia ultrasonográfica de reducción de la hipermovilidad uretral.
Para estudios comparativos, se realizaron biopsias de punción parauretrales en 10 pacientes antes del tratamiento y 60 días después de completar el tratamiento. Cada paciente biopsiado firmó un consentimiento informado aprobando el procedimiento de biopsia. Las muestras se fijaron en formol tamponado al 10% y luego se procesaron (desecación, inclusión en parafina y seccionamiento de 7 micras). Se realizaron tinciones con hematoxilina-eosina, tricromo de Masson, reactivo de ácido periódico de Schiff (PAS) e impregnación de plata para reticulina. Se analizó la calidad y cantidad de colágeno, la evidencia de elementos inflamatorios (edema, dilatación vascular, exudado celular), la densidad vascular, el estado de la matriz intercelular, la celularidad y los subtipos de colágeno.
Los pacientes fueron tratados de forma ambulatoria. Todos los pasos descritos a continuación están adaptados y actualizados de nuestro estudio piloto anterior. Todo el procedimiento se denominará como el sistema Luksenburg.
Las herramientas desarrolladas para realizar el procedimiento están patentadas y disponibles comercialmente en todo el mundo en el sitio web de Gyco Global.
Los pacientes se colocaron en posición de litotomía dorsal. Aproximadamente 25 minutos antes del procedimiento, se aplicó un anestésico tópico en la pared vaginal anterior que cubría el meato uretral, las áreas parauretrales, suburetrales y uretrovaginales laterales.
El tratamiento consta de 2 pasos, que duran aproximadamente 40 minutos:
El primero es la inyección de PRP en la pared vaginal anterior, y el segundo es la inserción de hilos de policaprolactona (PCL) en los espacios parauretrales, suburetrales y uretrovaginales laterales. Mientras se realizaban las maniobras y 24 horas después de finalizar el procedimiento, se evaluó a los pacientes para evaluar el dolor utilizando la escala analógica visual (VAS) y la escala de valoración numérica (NRS) para medir la intensidad del dolor.
Paso 1: Inyecciones de PRP en la Pared Vaginal Anterior
Se extraen ocho mililitros de sangre utilizando tubos de 4 mL con citrato de sodio al 3.8% (GyCO, Deltalab, España). Luego, se realiza una centrifugación durante 8 minutos a 1800 RPM. El plasma separado se extrae utilizando jeringas de 1 mm. Por cada jeringa de 1 mm, se mezclan 0.9 mL de plasma con 0.1 mL de cloruro de calcio (GyCO, Deltalab, España). Las jeringas de 1 mm se conectan a agujas de 30G × 1⁄2 (13 mm). Para facilitar las inyecciones transvaginales del PRP en la pared vaginal anterior, los autores han desarrollado un nuevo espéculo fenestrado (Figura 1). El espéculo fenestrado está hecho de acero inoxidable; tiene 2 fenestraciones laterales y longitudinales paralelas de 7 mm de ancho y 65 mm de largo. Separando las 2 fenestraciones hay un puente central y longitudinal sólido. La función del puente es proporcionar estabilidad al espéculo, protección mecánica de la uretra y guiar la colocación de las inyecciones de PRP y los hilos de PCL. Para indicar la posición del meato urinario, hay una marca de referencia a las 12 en punto. Después de colocar y posicionar el espéculo, el PRP se inyecta en la pared vaginal anterior a través de las 2 fenestraciones del espéculo, de atrás hacia adelante. Las infiltraciones de PRP se realizan inyectando solo el bisel de la aguja en la mucosa vaginal con un ángulo de 45 grados. Aproximadamente se coloca 0.2 mL de PRP con cada inyección. Se utilizan un promedio de 10 inyecciones de PRP por lado.
Paso 2: Colocación de Hilos de PCL
Los hilos de PDO están estériles; son compatibles con los tejidos y se reabsorben en 6 meses después de su colocación. El hilo de PCL tiene una longitud de 45 mm, un grosor de 0.15 mm (4-0) y una configuración de rosca montada en una aguja de 25G × 30 mm. Las agujas y los hilos fueron diseñados específicamente para encajar en los lugares seleccionados sin dañar las estructuras delicadas presentes en estos espacios, especialmente la uretra. Tanto las agujas como los hilos están disponibles comercialmente (GyCO Global. Shanxian Runte Medical International, Ltd, China). Los hilos de PCL se colocarán secuencialmente en las áreas parauretrales, uretrovaginales laterales y suburetrales. El acceso de los hilos de PCL al espacio uretral vaginal se monitorizó y realizó bajo visión de ultrasonido. El espéculo fenestrado está hecho de acero inoxidable; tiene 2 fenestraciones laterales y longitudinales paralelas de 7 mm de ancho y 65 mm de largo. Separando las 2 fenestraciones hay un puente central y longitudinal sólido. La función del puente es proporcionar estabilidad al espéculo, protección mecánica de la uretra y guiar la colocación de las inyecciones de PRP y los hilos de PCL. Para indicar la posición del meato urinario, hay una marca de referencia a las 12 en punto. Después de colocar y posicionar el espéculo, el PRP se inyecta en la pared vaginal anterior a través de las 2 fenestraciones del espéculo, de atrás hacia adelante. Las infiltraciones de PRP se realizan inyectando solo el bisel de la aguja en la mucosa vaginal con un ángulo de 45 grados. Aproximadamente se coloca 0.2 mL de PRP con cada inyección. Se utilizan un promedio de 10 inyecciones de PRP por lado.
Colocación de los Hilos de PCL en las Áreas Parauretrales
Colocación de los Hilos de PCL en las Áreas Parauretrales Para facilitar la colocación de los hilos de PCL, los autores han desarrollado un instrumento llamado Bayoneta 1. Actúa como una extensión de la mano del operador, permitiendo la inserción fácil de los hilos en la pared vaginal anterior. El mango de la bayoneta tiene una longitud de 10 cm y está unido a una varilla metálica de 13.5 cm de largo. En su extremo, la varilla tiene una forma de S con un ángulo de 30 grados. Tiene un puntero de presión que se adapta al cubo de la aguja con el hilo de PCL. Con el espéculo fenestrado en su lugar mostrando la marca del meato uretral a las 12 en punto, la bayoneta 1 con el hilo de PCL adjunto se guía hacia el cuarto anterior de una de las ventanas fenestradas. Los hilos se insertan en la pared vaginal de atrás hacia adelante, con un ángulo de 30 grados. Una vez que la aguja ha alcanzado 1 cm de profundidad, se avanza recta hasta que esté completamente insertada. Esta maniobra se realiza con guía ultrasónica. Luego se retira la bayoneta 1 con el cubo de la aguja, dejando el hilo de PCL libre en el área parauretral, paralelo a la uretra. El procedimiento se repite en el mismo lado 2 veces más. Se repite el mismo procedimiento en el lado contralateral.
Colocación de los Hilos de PCL en los Espacios Laterales Uretrovaginales
Para colocar hilos adicionales de PCL en el espacio uretrovaginal entre el área parauretral y la rama isquiopúbica ipsilateral, luego se gira el espéculo 1 cm hacia afuera, y se colocan 2 hilos de PCL a través de la ventana fenestrada. En algunos pacientes con espacios laterales uretrovaginales amplios, pueden ser necesarios hilos adicionales de PCL para llegar a la rama isquiopúbica. Estos hilos adicionales se colocan después de girar el espéculo hacia afuera 1 cm desde la posición anterior, y se colocan 2 o más hilos de PCL a través de la ventana fenestrada. Se repite el mismo procedimiento en el lado contralateral. Cada hilo de PCL se coloca desde el área parauretral hasta el espacio uretrovaginal a una distancia de aproximadamente 3 mm uno del otro. El número de hilos necesarios dependerá del espacio anatómico en cada paciente. Utilizamos de 16 a 24 hilos.Los hilos de PDO se colocarán secuencialmente en las áreas parauretrales, uretrovaginales laterales y suburetrales. El acceso de los hilos de PDO al espacio uretrovaginal vaginal se monitorizó y realizó bajo visión ecográfica.



Colocación de los Hilos de PCL en el Espacio Suburetral
Para facilitar la colocación de los hilos en el espacio suburetral, los autores han diseñado un instrumento llamado Bayonet 2. El instrumento tiene un mango de 10 cm de largo unido a una varilla de acero inoxidable de 13.5 cm de largo con una forma de S en su extremo con un ángulo de 29 grados. Al final de la sección recta de la varilla y 1.5 cm antes del inicio de la sección en forma de S, hay una estructura en forma de U con 2 brazos, cada uno de 8 mm de largo, paralelos a la varilla central. En el extremo de los 2 brazos, hay 2 punteros de presión que se adaptarán al cubo de las agujas con los hilos de PCL. Un catéter Foley está cortado a 4 cm de su extremo y se coloca para cubrir completamente el extremo romo de la varilla central. La varilla central con su catéter de cobertura es 2 cm más larga y 1.5 cm más alta que el extremo distal de las agujas. La apariencia final del instrumento se asemeja a un "tridente".
Con la paciente colocada en posición de litotomía semisentada, se retira el espéculo vaginal fenestrado y, bajo condiciones estériles, se lubrica la uretra y el catéter con gelatina (clorhidrato de lidocaína al 2%). Luego, se introduce la varilla central en la uretra durante aproximadamente 2 cm y luego se levanta ligeramente hacia arriba antes de que las agujas con los hilos de PCL entren en contacto con la mucosa vaginal. Esta maniobra protege la uretra de las agujas que se colocarán debajo de la uretra. En este punto, se introduce completamente el bayoneta 2. Luego, se retira el bayoneta y se colocan los 2 hilos de PCL liberados en el espacio suburetral (Figura 3C-D). La colocación de los hilos de PCL en los espacios suburetral, parauretral y uretrovaginal lateral se ha completado, creando una estructura similar a una malla que cubre el espacio uretrovaginal desde la rama isquiopúbica derecha hasta la izquierda.
El sistema Luksenburg se aplicó según el siguiente esquema:
- UI de grado I: 2 sesiones, cada una con 30 días de diferencia.
- UI de grado II: 3 sesiones, cada una con 30 días de diferencia.
- UI de grado III: 3 sesiones, cada una con 30 días de diferencia.
Todos los pacientes siguieron un protocolo de mantenimiento de 1 sesión cada 6 meses, además de ejercicios de Kegel.

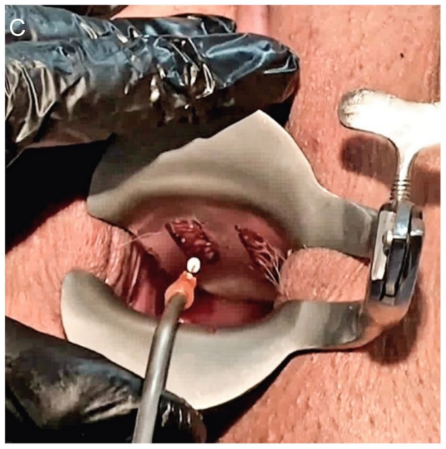

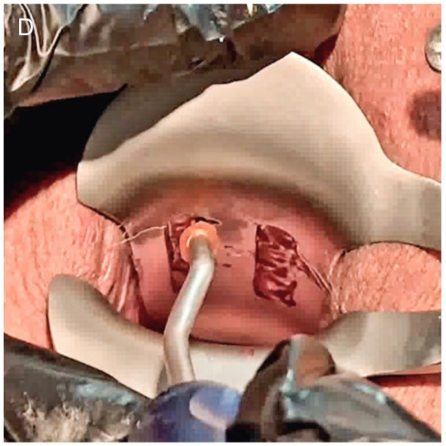
Resultados
Después del tratamiento, los pacientes de grado I mostraron una mejora sintomática en el 88% a los 7 días posteriores al tratamiento.
El 75% no mostró incontinencia clínica a los 30 días, aumentando al 95% a los 75 días. A los 90 días, el 92% tenía estudios urodinámicos normales.
Se observó un fracaso clínico y urodinámico para corregir la incontinencia en el 8% de los casos.
Respecto a los pacientes de grado II, se observó una mejora sintomática en el 45% a los 7 días, que aumentó al 53% a los 30 días. El 89% no mostró incontinencia clínica a los 75 días. El 89% tenía estudios urodinámicos normales a los 90 días. El 18% no mostró mejoría.
En cuanto a los pacientes de grado III, no se observó mejoría en la incontinencia a los 30 días posteriores al tratamiento. El 15% no tenía incontinencia a los 75 días. El 16% no mostró incontinencia clínica u urodinámica a los 105 días. El 82% de estos pacientes no mostraron ninguna mejoría.
La evaluación urodinámica preoperatoria demostró incontinencia urinaria objetiva en todos los casos. Después del tratamiento, los estudios urodinámicos normales se observaron en el 92% de los pacientes de grado I y en el 82% de los pacientes de grado II.
En el seguimiento a largo plazo, hasta 2 años, no se observó recidiva de la incontinencia en los grados I y II.
La mejora subjetiva de los síntomas apareció en promedio 5 días después del tratamiento. Las puntuaciones de ICIQ-UI SF mejoraron significativamente a las 4 semanas y 6 meses después del tratamiento. La puntuación media disminuyó de 12.5 a 0 después del tratamiento. No se observaron efectos adversos ni complicaciones asociadas con los procedimientos.
El tratamiento fue indoloro durante y hasta 24 horas después del procedimiento. No se observaron alteraciones funcionales, cicatrices hipertróficas ni alteraciones de la anatomía normal en la exploración clínica después del tratamiento. Las biopsias post-tratamiento mostraron cavidades en el tejido conectivo subepitelial, rodeadas por bandas de tejido conectivo denso. Se observó un aumento leve a moderado en la celularidad de los fibroblastos/miofibroblastos, la densidad vascular y el colágeno tipo III. No se observó aumento de las fibras de reticulina, fibras elásticas, elementos inflamatorios, granulomas, necrosis ni trombosis.
El 79% de los pacientes con síntomas mejorados declararon estar satisfechos con los resultados y expresaron su disposición a someterse nuevamente al procedimiento y recomendarlo a otros que sufren de IU leve.
Discusión
La debilidad y flacidez de los tejidos parauretrales, suburetrales y uretrovaginales laterales son dos de las principales causas responsables del desarrollo de la incontinencia urinaria por estrés. El novedoso sistema presentado aquí resulta en el fortalecimiento de los espacios parauretrales, suburetrales y uretrovaginales laterales y la mucosa de la pared vaginal anterior, apuntando a las áreas donde la uretra pasa de la vejiga al meato uretral.
La combinación de inyecciones de PRP a través de la mucosa de la pared vaginal anterior y la colocación de hilos de PCL en los espacios parauretrales, suburetrales y uretrovaginales laterales crea una estructura fibrosa y absorbible similar a una malla, con el objetivo de aumentar la resistencia uretral, de modo que bajo esfuerzo la presión intravesical no supere la presión uretral.
Una respuesta inmediata a las inyecciones de PRP en la mucosa vaginal anterior es el aumento del flujo sanguíneo, la permeabilidad vascular y el edema intersticial, lo que resultará en tumescencia del tejido periuretral durante aproximadamente 48 horas. Estos cambios son seguidos por la activación de fibroblastos y miofibroblastos. El estímulo en los fibroblastos desencadena la formación de nuevas fibras de colágeno y la tensión de la pared vaginal anterior. A largo plazo, el PRP tiene un efecto modulador sobre el proceso fibrogénico, previniendo la fibrosis excesiva que podría conducir a deformaciones debido al efecto retractil o nodulación.
Los hilos de PCL implantados en los espacios parauretrales, suburetrales y uretrovaginales laterales generan una reacción fibrogénica alrededor de los hilos que tiende a encapsularlos. Debido a que los hilos de PCL son inertes biológicamente, no ocurre una reacción a cuerpo extraño. La forma de tornillo sin fin de los hilos ayuda a crear más áreas de contacto con los tejidos hospedadores y desencadena una mayor reacción fibrogénica alrededor de los hilos. Los hallazgos histológicos tras los implantes de hilos de PCL se caracterizaron por la creación de una fibrosis tridimensional alrededor de los hilos, lo que resultó en la formación de una estructura similar a una malla alrededor de ellos, y que persistió después de la reabsorción de los hilos. Nuestros hallazgos fueron similares a los cambios previamente descritos en modelos animales y tejido humano después de los implantes de hilos de PDO. Sin embargo, los hilos de PCL se degradan más lentamente; por lo tanto, el estímulo fibrogénico es más prolongado en el tiempo, lo que resulta en resultados sustancialmente mejores en comparación con otros materiales.
El PCL es un polímero biocompatible, biodegradable y bioabsorbible, un poliéster alifático que pertenece al grupo de poli-α-hidroxiácidos, en el mismo grupo químico que los ácidos poliláctico y poliglicólico. El PCL es biocompatible. Se han realizado pruebas in vitro e in vivo de acuerdo con los estándares más avanzados (ISO 10993) para evidenciar la seguridad del PCL cuando se coloca en contacto con tejidos y fluidos humanos. El PCL es biodegradable y bioabsorbible. Aunque el análisis microscópico no mostró variaciones significativas en comparación con el PDO, los resultados funcionales son lo suficientemente buenos como para respaldar el uso de PCL.
El acceso de los hilos de PCL al espacio uretral vaginal se monitorizó y realizó bajo visión y control ultrasónicos transperineales. Es importante destacar que la elaboración de la malla de alambre de PCL en el espacio uretral vaginal, corroborada por la sonda transvaginal del equipo de ultrasonido, proporciona seguridad.
El sistema Luksenburg ofrece una alternativa no invasiva para pacientes de grado III que no pueden someterse a cirugía, mejorando los síntomas y la calidad de vida en casi el 20% de los casos. El sistema Luksenburg tiene un costo más bajo que los procedimientos quirúrgicos tradicionales y podría realizarse de forma ambulatoria sin necesidad de un entorno quirúrgico. Además, los pacientes volvieron a su vida normal inmediatamente después. Las herramientas, agujas y hilos necesarios para realizar adecuadamente la técnica están disponibles comercialmente en todo el mundo.
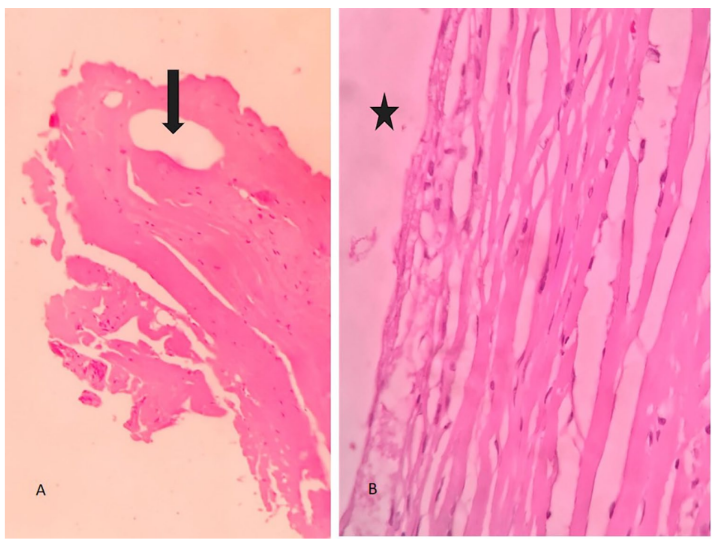
Conclusiones
Nuestro estudio demostró que el sistema Luksenburg, cuando es realizado por médicos capacitados, es una opción efectiva y segura mínimamente invasiva para el tratamiento de la UI de grado I y grado II, lo que puede reducir la necesidad de procedimientos invasivos más agresivos. Se necesitan estudios controlados aleatorizados para corroborar nuestros resultados.
Contribuciones de los Autores
Ariel Luksenburg: diseño, planificación, conducción, análisis de datos y redacción del manuscrito. Juan J. Barcia: diseño, planificación, análisis de datos, histopatología y redacción del manuscrito. Jorge Gaviria: diseño, planificación y conducción. Roberto Sergio: diseño, planificación y conducción. Santiago Fernandez: análisis de datos urodinámicos. Marco A. Pelosi II: planificación, conducción, análisis de datos y redacción del manuscrito. Marco A. Pelosi III: planificación, conducción, análisis de datos y redacción del manuscrito.
Declaración de Conflictos de Interés
El autor Ariel Luksenburg, MD, es CEO de GyCO Global. El resto de los autores no tienen conflictos de interés.
Financiamiento
El/los autor(es) no recibieron apoyo financiero para la investigación, autoría y/o publicación de este artículo.
ORCID iD
Ariel Luksenburg https://orcid.org/0000-0003-0057-5472
Biografías de los Autores
Ariel Luksenburg, MD, Práctica Privada, Montevideo, Uruguay. Juan J. Barcia, MD, Dept. de Patología Quirúrgica, Hospital de Clínicas, UdelaR, Montevideo, Uruguay. Roberto Sergio, MD, Dept. de Ginecología, Hospital de Maldonado, Maldonado, Uruguay. Santiago Fernández, MD, Clínica Urodinámica, Montevideo, Uruguay. Marco A. Pelosi II, MD, Centro Médico Pelosi, Bayonne, NJ, EE. UU. Marco A. Pelosi III, MD, Centro Médico Pelosi, Bayonne, NJ, EE. UU.
Ariel Luksenburg, MD, Práctica Privada, Montevideo, Uruguay.
Juan J. Barcia, MD, Dept. de Patología Quirúrgica, Hospital de Clínicas, UdelaR, Montevideo, Uruguay.
Jorge Gaviria, MD, Práctica Privada, Virginia, EE.UU.
Roberto Sergio, MD, Dept. de Ginecología, Hospital de Maldonado, Maldonado, Uruguay.
Santiago Fernández, MD, Clínica Urodinámica, Montevideo, Uruguay.
Marco A. Pelosi II, MD, Centro Médico Pelosi, Bayonne, Nueva Jersey, EE. UU.
Marco A. Pelosi III, MD, Centro Médico Pelosi, Bayonne, Nueva Jersey, EE. UU.


